რაიმე ნივთიერებაში ქიმიური ელემენტების ატომთა გამოვლენა, გამოსიხვებისა და შთანთქმის სპექტრში მათთვის დამახასიათებელი ხაზებით არის შესაძლებელი.
ბორის ატომის აღნაგობის თანახმად, ელექტრონების განლაგება ატომის ბირთვის გარშემო მკაცრად(”ნებადართულ”) განსაზღვრულ ორბიტებზე უნდა წარმოვიდგინოთ(პაულის პრინციპი). მათ ამავე დროს, ორბიტიდან ორბიტაზე დისკრეტული გადსვლაც შეუძლია, ენერგიის პორციის შთანთქმით ან გამოსხივებით, ამ მოვლენას კვანტური ნახტომი ეწოდება. თუ ელექტრონი დაბალ ორბიტაზე გადადის, ის ენერიას კარგავს, სინათლის კვანტის – ფოტონის(ატომი) გამოსხივებით, რომელსაც მკაცრად განსაზღვრული ტალღის სიგრძე აქვს, დამოკიდებული ენერგიის დაკარგვაზე კვანტური ნახტომის დროს. ასეთნაირად გამოსხივებული ფოტონების ნათებას გარკვეული ფერის სახით აღვიქვამთ – გავარვარებული სპილენძის სადენი, მაგალითად, ცისფრად ანათებს. ელექტრონს, უფრო მაღალ ორბიტზე გადსასვლელად, პირიქით, დამატებითი ენერგია ესაჭიროება, რომელსაც იგი ასევე განსაზღვრული ტალღის სიგრძის ფოტონების სახით შთანთქავს.
ატომებსა და სინათლეს შორის ასეთი ურთიერთქმედება, უმნიშვნელოვანესი ექსპერიმენტულ-გამოყენებითი მეცნიერების ნაწილად იქცა, რომელსაც სპექტროსკოპია, ან სპექტრული ანალიზი ეწოდება. იმის გამო, რომ სხვადასხვა ელემნტთა ბირთვები განსხვავებული რაოდენობის პროტონებს შეიცავს, მათ გარშემო კი განსხვავებულ ორბიტებზე ელექტრონებია განლაგებული(უფრო ზუსტი, თანამედროვე განმარტებით – ორბიტალებზე, რომლებიც ელექტრონის მდებარეობის ალბათობას განსაზღვრავს, არა მის ზუსტ ადგილსამყოფელს). ეს იმას ნიშნავს, რომ სხვადასხვა ქიმიური ელემენტების ატომებში ორბიტალებს შორის კვანტური ნახტომისთვის საჭირო ენერგია განსხვავებულია და სხვადასხვა სიგრძის ტალღა სხივდება. ნატრიუმის გამოსხივების ხილულ სპექტრში, ერთმანეთთან ახლოს, სპექტრის ყვითელ ნაწილში, მხოლოდ ორი ხაზი დაიმზირება(გაიხსენეთ ქუჩის განათების ნატრიუმიანი ნათურების მოყვითალო შუქი), ხოლო ვერცხლისწყლის სპექტრული ხაზების მდებარეობა მოლურჯო-ცისფერ ნაწილში მოდის.
ყოველი ქიმიური ელემენტის სპექტრული ხაზების ნაკრები უნიკალურია. თუ ატომი იონიზირებულია, ეს ნაკრები წაინაცვლებს და სპექტრში ახალ დამახასიათებელ სერიას ქმნის. ამგვარად, საკვლევი ნივთიერების სპექტრული ხაზების სერიათა აღმოჩენით(ან გამოსხივების სიხშირეების, რაც ერთი და იგივეა), მასში ამა თუ იმ ელემენტის შემცველეობაზე(ან პირიქით) დარწმუნებით შეგვიძლია ვილაპარკოთ(მაგალითად, უცნობი მასალის, უცნობი ქიმიური შემადგენელით, გავარვარებით გამახურებლის ალში).
httpv://www.youtube.com/watch?feature=player_detailpage&v=6HmvPGp85oE
ეს კი ემისიური სპექტროსკოპიის საფუძველია. სხვადასხვა ელემენტებისთვის დამახასიათებელი სპექტრული ხაზების გამოსხივების ინტენსიურობის შედარებით, ნივთიერებაში მათი რაოდენობრივი თანაფარდობისა და ქიმიური შემადგენელის გაგება შეგვიძლია. მანათობელი ობიექტების ქიმიური შემადგენელის შესახებ, მაგალითად, ვარსკვლავებისა და გალაქტიკების, რომლებიც ჩვენიდან კოლოსალურ დისტანციებზე მდებარეობს, მათი სპექტრის მიხედვით შეგვიძლია ვილაპარაკოთ.
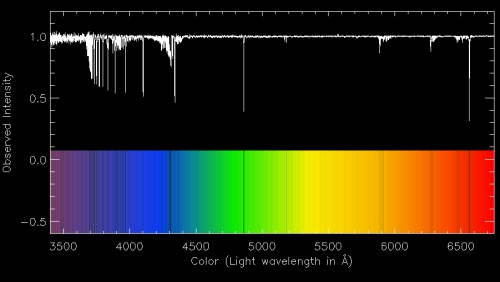
მსგავსი მეთოდით სარგებლობს აბსორბციული სპექტრისკოპიაც. ამ შემთხვევაში, მასხივებელ ნივთიერებაში თეთრ სინათლეს უშვებენ(ანუ ყველა ფერების ნაკრებს), ვლინდება შთანთქმის ხაზები, რომლებიც ელექტრონების უფრო მაღალ ორბიტალებზე გადასვლით გამოსხივებულ სიხშირეებს(ტალღის სიგრძეებს) შეესაბამება. აბსორბციული სპექტროსკოპია ასტროფიზიკის განუყოფელი თანამგზავრია – პლანეტების, ნისლეულების, გაზურმტვროვანი ღრუბლებისა და სხვა ობიექტების ქიმიური შემადგენელის დადგენა, რომელთაც საკუთარი ნათება არ გააჩნია, მათ უკან მდებარე თეთრი გამოსხივების, ვარსკვლავი-წყაროების სპექტრში ბნელი ხაზების მიხედვით ხდება(როგორ მუშაობს ლაზერი; სინათლის სიჩქარე; ელექტრომაგნიტური გამოსხივება).